Ottobre 17, 2024 Studi scientifici
La combinazione di resveratrolo e N-acetilcisteina è in grado di inibire lo sviluppo dei tumori indotti dagli estrogeni.
Il resveratrolo e la N-acetilcisteina inibiscono la fase iniziale dell’insorgenza dei tumori nelle cellule MCF-10F
Studio di riferimento
M. Zahida, M. Saeeda, C. Beselerb, E.G. Rogana, E.L. Cavalieri (2011). Resveratrol and N-acetylcysteine block the cancer-initiating step in MCF-10F cells Doi : 10.1016/j.freeradbiomed.2010.10.662
Abbreviazioni utilizzate nello studio
COMT : catecol-O-metiltransferasi
CYP : citocromo P450
E2-3,4-Q : estradiolo-3,4-chinone
GSH : glutatione
HPLC-ECD : cromatografia liquida ad alte prestazioni con rilevazione elettrochimicaMTT : 3-(4,5-dimetiltiazolo-2-il)-2,5-difeniltetrazolio bromuro
NAcCys : N-acetilcisteina
NQO1 e NQO2 : NAD(P) H chinone ossidoreduttasi 1 e 2
4-OCH3E1(E2) : 4-metossiestrone (estradiolo)
4-OHE1(E2) : 4-idrossiestrone (estradiolo)
Resv : resveratrolo
-SG : glutatione genetico
Introduzione
Numerose prove dimostrano che gli estrogeni-3,4-chinoni catecolari reagiscono con il DNA formando prevalentemente gli addotti depurativi 4-idrossiestrone (estradiolo)-1-N3Ade [4-OHE1(E2)-1-N3Ade] e 4-OHE1(E2)-1-N7Gua.
I siti apurinici risultanti da questi addotti generano mutazioni critiche che sono alla base dell’insorgenza del tumore.
Il modello di insorgenza del cancro si basa su uno squilibrio nel metabolismo degli estrogeni tra le vie di attivazione che portano alla formazione degli addotti estrogeno-DNA e le vie di disattivazione che portano alla formazione dei metaboliti e dei coniugati degli estrogeni.
Questo squilibrio può essere migliorato per ridurre al minimo la formazione di addotti utilizzando antiossidanti come il resveratrolo (Resv) e la N-acetilcisteina (NAcCys).
Per valutare l’efficacia di Resv e NAcCys nel prevenire la formazione di addotti estrogeno-DNA, abbiamo utilizzato la linea cellulare epiteliale mammaria umana MCF-10F trattata con 4-OHE2.
Resv e NAcCys hanno indirizzato il metabolismo di 4-OHE2 verso processi protettivi.
La NAcCys ha reagito con i chinoni riducendoli a catecoli.
Questo processo è avvenuto anche con Resv.
Inoltre, Resv ha indotto l’enzima protettivo chinone reduttasi, che riduce gli E1(E2)-3,4-chinoni a 4-OHE1(E2).
Resv è risultato più efficace nell’aumentare la quantità di 4-OCH3E1(E2) rispetto alla NAcCys.
L’inibizione della formazione dell’addotto estrogeno-DNA era efficace a dosi più basse, ma a dosi più elevate Resv era circa il 50% più efficace di NAcCys.
I loro effetti combinati erano additivi.
Pertanto, questi due antiossidanti rappresentano un’ottima combinazione per proteggere gli estrogeni catecolici dall’ossidazione a chinoni catecolici.
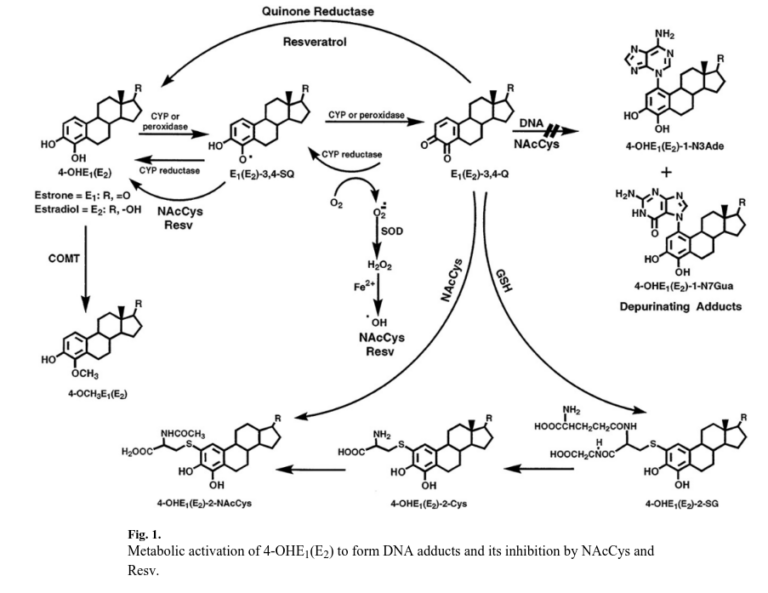
Le prove derivanti da esperimenti sul metabolismo degli estrogeni [1-3], sulla formazione di addotti del DNA [4-8], sulla mutagenicità [9-13], sulla trasformazione cellulare [14-16] e sulla cancerogenicità [17-20] suggeriscono che alcuni metaboliti degli estrogeni, in particolare gli estrogeni catecolici-3,4-chinoni, reagiscono con il DNA formando prevalentemente gli addotti depuranti 4-idrossiestrone (estradiolo)-1-N3Ade [4-OHE1(E2)-1-N3Ade]1 e 4-OHE1(E2)-1-N7Gua [4-6] (Fig. 1).
I siti apurinici risultanti dalla formazione di questi addotti possono essere soggetti a un processo di riparazione a rischio di errore che può generare mutazioni critiche in grado di dare inizio alla formazione di un tumore [9-11,21].
Questo modello di insorgenza del tumore si basa sull’alterazione dell’equilibrio omeostatico del metabolismo legato agli estrogeni.
Si tratta di un equilibrio tra vie di attivazione che portano alla formazione di addotti estrogeno-DNA e vie di disattivazione che portano alla formazione di metaboliti e coniugati degli estrogeni (Fig. 1).
A sostegno di questa ipotesi vi sono i risultati ottenuti in donne il cui livello di addotti estrogeno-DNA nelle urine è basso e i cui livelli di coniugati estrogenici sono elevati.
Al contrario, nelle urine di donne con tumore al seno o ad alto rischio di contrarre questa malattia si riscontrano livelli più elevati di addotti e livelli più bassi di coniugati [7,22].
L’ossidazione degli estrogeni catecolici a chinoni può essere limitata mediante l’intervento di enzimi di fase II.
Ad esempio, la catecol-O-metiltransferasi (COMT) catalizza la metilazione degli estrogeni catecolici, impedendo così la loro conversione in estrogeni semichinoni e chinoni (Fig. 1).
Abbiamo infatti osservato un aumento della formazione di addotti estrogeno-DNA quando l’attività della COMT è stata inibita [23,24].
Una seconda coniugazione che impedisce la reazione dei chinoni catecolici estrogenici con il DNA è fornita dall’antiossidante cellulare glutatione (GSH), in modo non enzimatico o, più efficacemente, grazie all’azione catalitica della glutatione S-transferasi.
Anche altri enzimi di fase II, come le chinone reduttasi (NQO1 e NQO2), sono implicati nella detossificazione dei chinoni attraverso la loro riduzione a estrogeni catecolici [25-27] (Fig. 1).
L’equilibrio tra le vie di attivazione e disattivazione che portano rispettivamente agli addotti estrogeno-DNA o agli estrogeni coniugati può essere ulteriormente migliorato per minimizzare la formazione di addotti e massimizzare quella di coniugati.
L’uso di specifici composti antiossidanti può potenzialmente raggiungere un migliore equilibrio dell’omeostasi degli estrogeni.
In uno studio preliminare in vitro, abbiamo testato diversi antiossidanti, come la cisteina, la N-acetilcisteina (NAcCys), il GSH, la melatonina, il resveratrolo (Resv) e l’acido lipoico ridotto [28].
I migliori inibitori della formazione di addotti depurativi estrogeno-DNA sono risultati il resveratrolo (Resv) e la NAcCys.
La NAcCys è un acetilamino tiolo.
Il suo prodotto idrolitico, la cisteina, è uno dei tre aminoacidi presenti nell’antiossidante intracellulare GSH [29].
Le alterazioni dell’omeostasi del GSH sono state associate a diverse patologie nell’uomo, tra cui anche il cancro [30].
La NAcCys è stata utilizzata come farmaco mucolitico [31] e come antidoto per l’avvelenamento da paracetamolo [32].
Il Resv (3,5,4′-triidrossistilbene) è un antiossidante naturale presente nell’uva e in molte altre piante [37] e ha effetti anticancerogeni in diversi sistemi in vitro e in vivo [38,39].
Abbiamo utilizzato la linea cellulare epiteliale mammaria umana MCF-10F (negativa per il recettore degli estrogeni-α e positiva per il recettore degli idrocarburi arilici) per studiare gli effetti di Resv [16,40] e NAcCys [41] sul metabolismo degli estrogeni e sulla formazione di addotti estrogeno-DNA.
In questo studio abbiamo confrontato la capacità di Resv e NAcCys di inibire la formazione di addotti estrogeno-DNA, testando i due composti singolarmente e miscelandoli tra loro.
Materiali utilizzati e metodologie
Prodotti chimici e reagenti
Il 4-OHE2 e tutti gli standard sono stati sintetizzati nel nostro laboratorio, come precedentemente descritto [4,5,42,43].
Tutte le altre sostanze chimiche sono state acquistate dalla Sigma-Aldrich (St. Louis, MO, USA) e sono state impiegate senza subire ulteriori processi di purificazione.
Coltura e trattamento delle cellule
Le cellule MCF-10F sono state ottenute dall’ATCC (Rockville, MD, USA) e coltivate in DMEM e Ham’s F12 medium (Mediatech) con 20 ng/ml di fattore di crescita epidermico, 0,01 mg/ml di insulina, 500 ng/ml di idrocortisone, 5% di siero di cavallo e 100 μg/ml di penicillina/streptomicina.
Il terreno di coltura privo di estrogeni è stato preparato in terreno DME/F12 privo di fenolo rosso con siero di bovino fetale (FBS) privato del carbone (HyClone, Logan, UT, USA).
La vitalità cellulare è stata determinata mediante il saggio MTT [3-(4,5-dimetiltiazolo-2-il)-2,5-difeniltetrazolio bromuro ; Sigma] [44].
Test di citotossicità
Le cellule sono state coltivate ad una densità di 3000 cellule/pozzetto in piastre da 96 pozzetti.
Dopo 8 ore (giorno 0), le cellule presenti in una piastra a 96 pozzetti sono state raccolte con il test MTT (vedi sotto), mentre le altre cellule sono state trattate con 4-OHE2 (10 μM) con o senza la presenza di varie dosi di NAcCys (0,6-60 μM) e Resv (0,37-36 μM) da sole o in combinazione tra loro.
Le cellule sono state ulteriormente incubate per 24-72 ore.
Nel saggio MTT, il terreno delle colture in piastra a 96 pozzetti è stato sostituito con 100 μl di terreno fresco contenente 25 μl di MTT (5 mg/ml in PBS) ed è stato incubato per 2 h a 37 °C per consentire la riduzione dell’MTT da parte delle cellule metabolicamente attive e la formazione di un frammento di formazina viola.
Il frammento è stato quindi solubilizzato aggiungendo 100 μl di una soluzione di SDS al 20% in DMF:H₂O 1:1, pH 4,7. La miscela è stata incubata per tutta la notte a 37 °C.
Il colore viola è stato misurato a 570 nm in uno spettrofotometro per micropiastre μQuant (Bio-Tek Instruments) e analizzato con il software KCjunior (versione 1.41).
I valori di assorbanza sono stati convertiti in percentuale di cellule vitali rispetto al valore di assorbanza del campione bianco.
Metabolismo
Le cellule MCF-10F (0,75×105 cellule) sono state coltivate per 24 ore in un terreno contenente estrogeni.
Per valutare l’effetto degli antiossidanti sul metabolismo degli estrogeni, le cellule sono state prima preincubate per 48 ore con dosi selezionate di Resv o NAcCys da sole o in combinazione, lavate con PBS e, dopo l’aggiunta di terreno fresco, trattate con 10 μM 4-OHE2 per 24 ore con o senza antiossidante.
Per mantenere la stessa concentrazione di etanolo (0,001%) in tutti gli esperimenti, sono state preparate diverse soluzioni stock di NAcCys (0,6-60 mM) e Resv (0,37-36 mM).
I terreni di cinque fiasche T-150 di cellule MCF-10F trattate con uguali quantità di soluzione organica sono stati utilizzati come controllo.
Una volta rimosso il terreno da ciascuna fiasca, queste sono state incubate a 37 °C con 1 ml di tripsina.
Dopo 10 minuti, sono stati aggiunti 10 ml di terreno a doppio siero per combinare le cellule di tutte e cinque le fiasche.
Il numero di cellule è stato stimato con un contatore Coulter (Beckman Coulter).
Analisi degli addotti di estrogeni-DNA
I terreni sono stati raccolti, integrati con acido ascorbico 2 mM (per prevenire la possibile decomposizione dei composti) e trattati immediatamente.
La preparazione dei campioni e l’analisi mediante HPLC con rivelazione elettrochimica (HPLC-ECD) sono state effettuate secondo le istruzioni che verranno fornite a breve.
Preparazione dei campioni
I terreni di coltura provenienti da cinque fiasche da 50 ml sono stati trattati mediante passaggio attraverso le cartucce C8 Certify II (Varian, Harbor City, CA, USA), che sono state calibrate facendo passare in sequenza 1 ml di metanolo, acqua distillata e soluzione tampone di fosfato di potassio (100 mM, pH 8).
I terreni di coltura raccolti (50 ml) sono stati portati a pH 8,0 e quindi fatti passare attraverso le cartucce.
Gli elementi raccolti sono stati fosfato, eluiti con metanolo:acetonitrile:acqua:acido trifluoroacetico (8:1:1:0.1) e trattati come descritto in precedenza [15].
HPLC-ECD
Le analisi di tutti i campioni sono state condotte su un sistema HPLC dotato di due moduli di erogazione del solvente ESA Model 580, un autocampionatore ESA Model 540 e un rivelatore elettrochimico CoulArray a 12 canali (ESA, Chelmsford, MA, USA), utilizzando il metodo precedentemente descritto [15].
Per ogni standard sono state eseguite curve di calibrazione a tre punti e, per ogni punto di dati, sono stati analizzati campioni in triplo.
Per identificare gli analiti sono stati utilizzati il loro tempo di ritenzione e i rapporti di altezza dei picchi tra il picco dominante e i picchi dei due canali adiacenti.
La quantificazione degli analiti è stata effettuata per confronto con le quantità note di standard.
La percentuale di recupero di ogni standard è stata utilizzata per normalizzare i dati.
Informazioni dettagliate, insieme a un cromatogramma, sono state riportate in precedenza [41].
Analisi statistica
Citotossicità : abbiamo utilizzato un’analisi multivariata a misure ripetute per verificare se la sopravvivenza cellulare fosse significativamente diversa tra le cellule trattate con 4-OHE2 e quelle non trattate con dosi crescenti di NAcCys a 24, 48 e 72 ore.
Le variabili dipendenti erano le nove dosi, ciascuna trattata come variabile indipendente.
Poiché la dimensione del campione era modesta per ciascuna dose e sono stati valutati sia il gruppo di trattamento che il tempo, è stato applicato il fattore di correzione epsilon di Huynh-Feldt ai valori di p univariati, in quanto i residui non erano normalmente distribuiti all’interno di ciascun gruppo di trattamento [45].
I risultati multivariati sono validi nonostante la mancata osservanza di questo presupposto.
Per le statistiche F è stato utilizzato il test della traccia di Pillai e i valori di p sono stati calcolati per la significatività complessiva tra i modelli.
Metabolismo : tutti gli esperimenti sono stati replicati in modo indipendente almeno tre volte.
I dati sono presentati come medie ± deviazione standard.
I coniugati metossilici, i coniugati chinonici e gli addotti del DNA sono stati tracciati separatamente per Resv da solo, NAcCys da solo e Resv più NAcCys a nove combinazioni di dosi.
I grafici dose-risposta individuali di Resv e NAcCys sui livelli di coniugato metossilico, coniugato chinonico e addotto del DNA hanno mostrato che le curve dose-risposta non erano costantemente parallele, indicando la presenza di relazioni più complesse.
Pertanto, abbiamo testato l’indipendenza e il sinergismo/antagonismo utilizzando le equazioni di Bliss.
Per modellare la risposta alla dose è stata utilizzata la regressione non lineare e l’indipendenza o il sinergismo/antagonismo sono stati testati utilizzando i modelli di Bliss [46].
Le coppie di dosi sono state raggruppate in quattro categorie come segue : (1) nessun trattamento antiossidante; (2) NAcCys>0 e Resv = 0; (3) NAcCys = 0 e Resv>0; e (4) NAcCys>0 e Resv>0.
L’indipendenza di Bliss presuppone che due agenti contribuiscano ciascuno ad un effetto, ma non interferiscano l’uno con l’attività dell’altro, ipotesi che si applica sulla base dei meccanismi d’azione di Resv e NAcCys.
Il sinergismo di Bliss si verifica quando, a determinate dosi, l’effetto combinato è maggiore rispetto alla somma degli effetti di ciascun agente preso singolarmente.
L’antagonismo si verifica quando la combinazione dei due agenti produce un effetto meno potente di quello dei due agenti presi singolarmente.
Il modello di Bliss è un’estensione del modello di regressione logistica a quattro parametri che introduce un parametro chiamato “ν”, il cui valore, quando è uguale a 1, indica che due agenti sono indipendenti; valori compresi tra 0 e 1 indicano antagonismo, mentre valori superiori a 1 indicano sinergia.
Il parametro ν viene aggiunto alle curve dose-risposta dei singoli agenti per verificare se il modello migliora dopo aver considerato l’interazione tra i due composti.
Abbiamo utilizzato questi tre modelli per esaminare la relazione di ciascun agente e della combinazione di agenti sui livelli di coniugato metossilico, coniugato chinonico e addotto del DNA.
I modelli consentono di quantificare l’antagonismo, l’additività o il sinergismo con un test statistico di significatività per l’adattamento del modello.
Tutte le analisi sono state eseguite in SAS versione 9.2 (SAS Institute, Cary, NC, USA).
Risultati ed analisi
NAcCys e Resv invertono la tossicità del 4-OHE2 sulle cellule MCF-10F
In questo studio abbiamo esaminato l’effetto citotossico di 4-OHE2 sulle cellule MCF-10F utilizzando il saggio MTT.
Abbiamo osservato una certa citotossicità nelle cellule MCF-10F esposte a 10 μM di 4-OHE2 per 72 ore rispetto alle cellule di controllo (Fig. 2), con le cellule trattate che hanno mostrato una mortalità cellulare del 42% dopo 72 ore di incubazione.
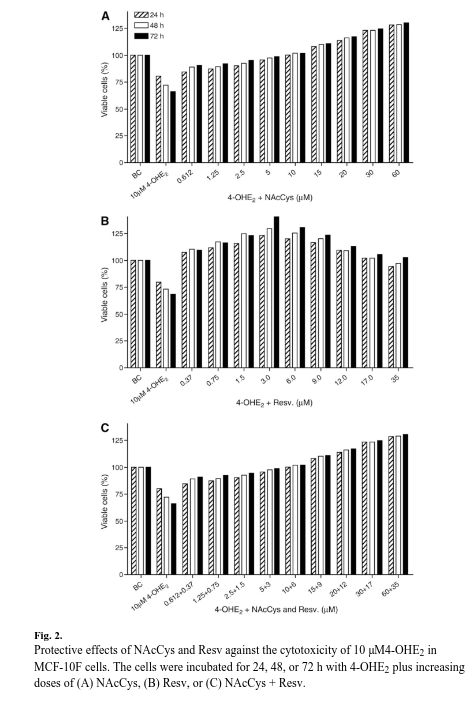
I grafici della percentuale di cellule vitali per esaminare gli effetti di NAcCys e Resv sulla citotossicità di 4-OHE2 sono stati costruiti convertendo i valori di assorbanza MTT delle cellule trattate in rapporti (percentuale di cellule vitali) nei giorni 1, 2 e 3 rispetto a quelli dei pozzetti di controllo e sono stati tracciati come un corso temporale.
Abbiamo trattato le cellule MCF-10F con una miscela di 4-OHE2 (10 μM) più concentrazioni crescenti di NAcCys (0,6-60 μM) e/o Resv (0,37-36 μM) e abbiamo esaminato le cellule vitali per 0-72 h (Fig. 2).
I risultati indicano che la NAcCys può proteggere le cellule dagli effetti citotossici del 4-OHE2 (Fig. 2A).
Ad esempio, l’aggiunta di NAcCys ha aumentato il numero di cellule vitali MCF-10F trattate con 10 μM di 4-OHE2 del 24% dopo 72 ore (dal 66 al 90%).
È interessante notare che 10 μM NAcCys ha abolito l’effetto tossico di 4-OHE2 a 24, 48 e 72 ore.
Dosi più elevate di NAcCys (15-60 μM) hanno superato la tossicità del 4-OHE2, promuovendo la crescita cellulare a livelli più elevati rispetto alle colture di controllo non trattate (ad esempio, a 72 h, il numero di cellule vitali è aumentato del 110-129%, Fig. 2A).
Sono state riscontrate differenze statisticamente significative sia per la dose che per il tempo (tutte p<0,0001), il che indica che concentrazioni crescenti di NAcCys hanno migliorato la vitalità delle cellule a intervalli temporali successivi.
Le incubazioni con Resv hanno mostrato che questo composto è leggermente più efficace di NAcCys. NAcCys, e anche la dose più bassa di Resv (0,37 μM), ha completamente eliminato il danno citotossico indotto da 10 μM 4-OcCys in 72 ore (Fig. 2B).
L’effetto protettivo del Resv nei confronti del 4-OHE2 era più evidente con l’aumentare della dose.
Dati simili sono stati osservati quando entrambi i composti (NAcCys e Resv) sono stati combinati (Fig. 2C).
Pertanto, i due antiossidanti non erano citotossici, ma al contrario hanno protetto le cellule.
Inibizione della formazione di addotti estrogeno-DNA da parte di Resv e NAcCys
Nei nostri esperimenti con le cellule MCF-10F, abbiamo suddiviso i prodotti metabolici del 4-OHE2 in tre categorie di composti : (1) coniugati metossilici [4-OCH3E1(E2)], (2) coniugati chinonici [4-OHE1(E2)-2-SG; 4-OHE1(E2)-2-NAcCys e 4-OHE1(E2)-2-Cys] e (3) addotti estrogeno-DNA depuranti [4-OHE1(E2)-1-N3Ade e 4-OHE1 (E2)-1-N7Gua].
In studi precedenti abbiamo osservato che la formazione di coniugati metossilici e chinonici e di addotti estrogeno-DNA aumenta con dosi più elevate di catecoli o chinoni estrogenici [23,24].
Negli esperimenti qui riportati, abbiamo deciso di utilizzare una dose minimamente citotossica di 4-OHE2 (10 μM) con o senza diverse dosi di antiossidante (Resv o NAcCys) da solo o in combinazione.
Nelle nostre condizioni sperimentali, abbiamo osservato che dopo il trattamento il 4-OHE2 libero non era rilevabile.
Una parte importante è stata convertita nel coniugato metossilico [4-OCH3E1(E2)] dalla presenza abbondante di COMT nelle cellule [23,24], mentre i catecoli rimanenti sono stati ossidati per formare l’E1(E2)-3,4-Q.
I chinoni hanno tre importanti sorti (Fig. 1) : in primo luogo, possono essere ridotti dalla chinone reduttasi (NQO1 o NQO2) [25-27] a catecoli, che possono essere nuovamente metilati dalla COMT o riossidati a chinoni. riossidati a chinoni.
In secondo luogo, i chinoni possono reagire con il GSH endogeno per formare GSH coniugati.
In terzo luogo, i chinoni possono reagire con il DNA per formare addotti estrogeno-DNA.
Il trattamento delle cellule con 10 μM di 4-OHE2 da solo ha mostrato il risultato atteso (Figg. 3-5), cioè la formazione di metossi e chinoni, la formazione di coniugati metossilici e chinonici e di addotti estrogeno-DNA depuranti.
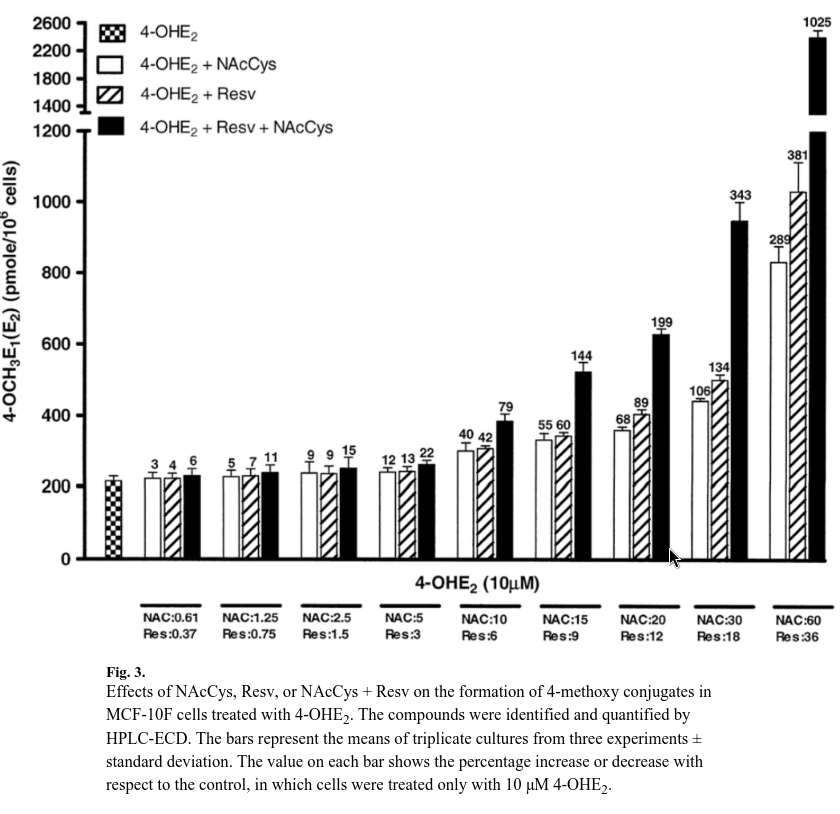
Coniugati metossilici
L’aggiunta di NAcCys e/o Resv ha sostanzialmente indirizzato il metabolismo degli estrogeni verso applicazioni terapeutiche.
A basse dosi di NAcCys, questo effetto non era evidente, ma quando NAcCys ha raggiunto un rapporto 1:1 con 4-OHE2, ha aumentato significativamente il livello di coniugati metossilici da 214 ± 25 a 299 ± 40 pmol/milione di cellule (aumento del 40%, Fig. 3).
Un effetto simile è stato osservato con 6 μM Resv, in quanto il livello di coniugati metossilici è aumentato del 42%, corrispondente a 305 ± 14 pmol/milione di cellule.
Inoltre, quando entrambi i composti antiossidanti sono stati aggiunti insieme, l’effetto è stato maggiore e il livello di coniugato metossilico è aumentato del 79%.
Pertanto, il livello di composti metossilici è aumentato con rapporti più elevati di antiossidanti da soli o miscelati insieme.
Alla dose più alta, in cui NAcCys era in rapporto 1:6 e Resv in rapporto 1:3,6 rispetto a 4-OHE2, i coniugati metossilici erano maggiori con Resv, con un aumento del 381%, mentre con NAcCys l’aumento era del 298%.
Con la miscela, l’aumento era del 1025%, che è tre volte superiore rispetto all’azione dei singoli composti antiossidanti (Fig. 3).
Questo risultato può essere spiegato dall’osservazione di esperimenti precedenti nei quali NAcCys e Resv hanno ridotto i semichinoni estrogenici prodotti in queste cellule durante l’ossidazione del 4-OHE ai catecoli [16,28,47].
La grande quantità di COMT nelle cellule assicura che il 4-OHE2 venga convertito in 4-OCH3E1(E2) [23,24].
Pertanto, Resv è risultato più efficace di NAcCys nell’aumentare la quantità di 4-OCH3E1(E2).
Tuttavia, i tentativi di modellizzazione non lineare della curva dose-risposta del coniugato metossilico hanno dato luogo a risultati non convergenti a causa di matrici Hessiane non singolari.
Pertanto, non è stato possibile condurre test statistici di antagonismo, additività o sinergia.
Coniugati chinonici
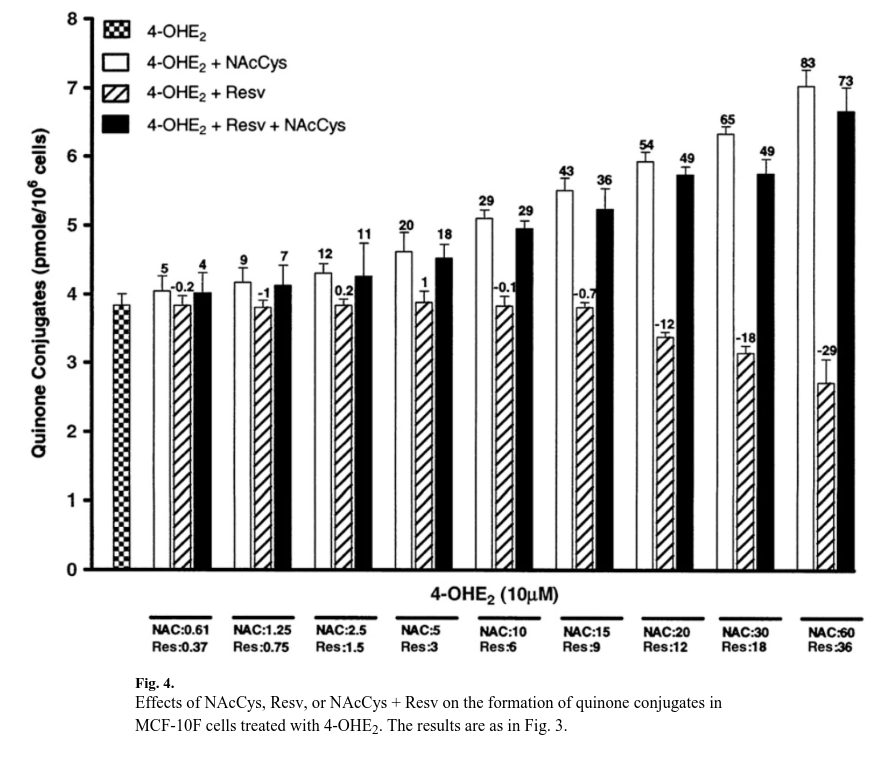
Sono stati osservati risultati interessanti per i coniugati chinonici, che sono aumentati con dosi più elevate di NAcCys (Fig. 4).
Alla dose più alta, tale aumento è stato di circa due volte.
Ciò è comprensibile, poiché la NAcCys può reagire direttamente con i chinoni catecolici per formare 4-OHE1(E2)-2-NAcCys [43].
Analogamente, la NAcCys è un precursore del GSH, che, a sua volta, reagisce con E1(E2)-3,4-Q per formare coniugati di GSH.
Questi si convertono, attraverso la via dell’acido mercapturico a 4-OHE1(E2)-2-Cys e 4-OHE1(E2)-2-NAcCys (Fig. 1).
D’altra parte, Resv non ha mostrato alcun effetto sulla formazione di coniugati chinonici a basse dosi, mentre alle due dosi più alte (18 e 36 μM), il livello di coniugati chinonici è diminuito sensibilmente (Fig. 4).
L’effetto di Resv sui coniugati chinonici può essere spiegato dalla nostra precedente scoperta secondo cui Resv non reagisce con E2-3,4-Q per formare alcun composto coniugato [28].
D’altra parte, Resv mostra un potenziale maggiore nel ridurre il semichinone a catecolo rispetto a NAcCys, e induce anche l’enzima NQO1, che riduce il chinone a catecolo. [16,25,28,40].
Tutti questi processi riducono il livello di chinoni disponibili per la formazione di coniugati.
Negli esperimenti in cui entrambi gli antiossidanti sono stati utilizzati insieme, il livello di coniugati è aumentato moderatamente, ma a tutte le dosi selezionate il livello rispecchia il contributo della NAcCys (Fig. 4).
Osservando la Fig. 4, risulta evidente che Resv e NAcCys hanno effetti opposti sulla formazione di coniugati chinonici.
La curva dose-risposta per i due agenti è risultata parallela, ma tre dei quattro parametri di regressione logistica erano in direzione negativa.
I dati si adattavano adeguatamente al modello di Bliss (p<0,0001), ma il parametro ν era 0,82 (intervallo di confidenza al 95% 0,70-0,97), indicando una relazione antagonistica tra NAcCys e Resv sui livelli di chinone coniugato.
Questi risultati confermano che l’effetto principale dell’NAcCys sui livelli di chinoni coniugati è quello di reagire con i chinoni stessi.
Addotti estrogeno-DNA
Dunque, NAcCys e Resv influenzano il metabolismo degli estrogeni nelle cellule MCF-10F, riducendo i livelli di chinoni dal punto di vista chimico (riducendo i semichinoni) e biologico (inducendo gli enzimi protettivi di fase II).
I chinoni sono essenziali per la reazione con il DNA e la formazione di addotti estrogeno-DNA.
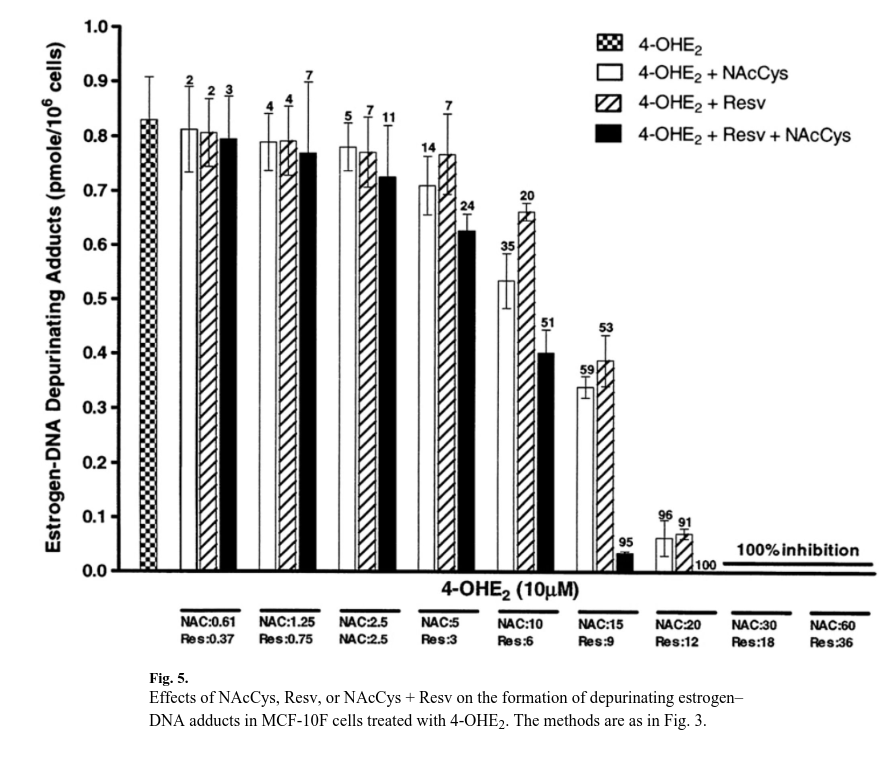
È stata osservata una drastica riduzione del livello di addotti estrogeno-DNA depuranti, che si formano prevalentemente (99%) rispetto agli addotti stabili (1%) [28].
Alle dosi in cui NAcCys è 15 μM e Resv è 9 μM, il livello di addotti è stato ridotto da 0,83±0,14 a 0,34±0,03 (diminuzione del 59%) e da 0,39±0,08 a 0,19±0,03 pmol/milione di cellule (diminuzione del 53%), rispettivamente (Fig. 5).
Se somministrate insieme, queste dosi hanno un effetto additivo e il livello di addotti è sceso a 0,03±0,001 (riduzione del 95%).
Le dosi di 20 μM NAcCys e 12μM Resv hanno ridotto il livello di addotto rispettivamente del 96 e del 91%, mentre la miscela ha mostrato un’inibizione completa.
Le due dosi più alte hanno mostrato un’inibizione del 100%, sia da sole che in miscela (Fig. 5).
I test statistici hanno mostrato che il modello di regressione logistica a quattro parametri si adattava significativamente ai dati quando nel modello era incluso il termine di interazione (p<0,0001).
Il parametro ν sotto il modello di sinergia/antagonismo di Bliss era 1,33 (intervallo di confidenza al 95% 0,87-2,02), valore leggermente superiore a 1, che indicava la presenza di sinergismo alle dosi più alte, ma il risultato non era statisticamente significativo.
Tuttavia, il modello di indipendenza di Bliss era indipendente dal parametro ν ed è stato riscontrato un migliore adattamento dopo la sua eliminazione dal modello, il che suggerisce che Resv e NAcCys agiscono complessivamente in modo additivo sui coniugati metossilici, sui coniugati chinonici e sulla formazione di addotti del DNA.
In sintesi, l’inibizione della formazione dell’addotto estrogeno-DNA è risultata simile a dosi inferiori di NAcCys e Resv, ma a dosi più elevate l’effetto di Resv è risultato superiore di circa il 50% rispetto a quello di NAcCys.
I livelli di addotti estrogeno-DNA depuranti sono considerati il punto di partenza che genera le mutazioni che possono portare al cancro al seno.
Questi due antiossidanti (NAcCys e Resv) possono essere utili per approfondire il legame tra il metabolismo ossidativo degli estrogeni e l’insorgenza del cancro al seno.
Conclusioni
Il metabolismo degli estrogeni è caratterizzato da due principali processi.
Il primo è la 16α-idrossilazione e il secondo è la formazione di catecoli per idrossilazione delle posizioni 2 e 4 [1,2].
La 16α-idrossilazione non è coinvolta in alcuna reazione specifica con il DNA, mentre l’ossidazione dei 2 e 4 catecoli porta ai rispettivi chinoni, che possono reagire con il DNA.
La reazione più efficace di questi chinoni con il DNA si verifica quando si formano i 3,4-chinoni.
In questo caso, una reazione di Michael protonata ad 1.4 molto efficace [46] porta alla formazione predominante (99%) di addotti estrogeno-DNA depuranti [6,7].
Numerose prove indicano che questa reazione con il DNA, che forma prevalentemente gli addotti depurativi N3Ade e N7Gua, è in grado di avviare una serie di fenomeni che portano alla formazione di un tumore [21].
Questa reazione con il DNA avviene in modo più efficiente quando il metabolismo degli estrogeni è sbilanciato, ovvero quando si verifica una formazione eccessiva di chinoni, che possono reagire con il DNA.
La reazione dei chinoni catecolici degli estrogeni con il DNA può essere ridotta mediante l’uso di antiossidanti specifici come NAcCys e Resv.
La NAcCys esercita i suoi effetti protettivi per via chimica.
Infatti, la NAcCys reagisce direttamente con i chinoni catecolici degli estrogeni e viene idrolizzata a cisteina, che viene utilizzata nella biosintesi dell’antiossidante cellulare GSH (Fig. 1).
Inoltre, la NAcCys riduce i semichinoni degli estrogeni a catecoli (Fig. 1), diminuendo in questo modo la quantità di chinoni presenti nella cellula.
La riduzione dei semichinoni a catecoli si ottiene anche con il Resv [16,40]. Il Resv, tuttavia, esercita anche effetti protettivi enzimatici, ossia induce NQO1, che riduce i chinoni a catecoli (Fig. 2), e modula l’espressione di CYP1B1, che metabolizza specificamente l’E2 a 4-OHE2 (Fig. 1).
In conclusione, questi due antiossidanti costituiscono un’eccellente combinazione per minimizzare il metabolismo degli estrogeni da catecoli a chinoni catecolici.
Grazie a questi effetti, la combinazione di NAcCys e Resv è in grado di inibire lo sviluppo dei tumori indotti dagli estrogeni.
Bibliografia
1. Zhu BT, Conney AH. Functional role of estrogen metabolism in target cells : review and perspectives. Carcinogenesis. 1998; 19:1–27. [PubMed : 9472688]
2. Cavalieri EL, Kumar S, Todorovic R, Higginbotham S, Badawi AF, Rogan EG. Imbalance of estrogen homeostasis in kidney and liver of hamsters treated with estradiol : implications for
estrogen-induced initiation of renal tumors. Chem. Res. Toxicol. 2001; 14:1041–1050. [PubMed : 11511178]
3. Rogan EG, Badawi AF, Devanesan PD, et al. Relative imbalances in estrogen metabolism and conjugation in breast tissue of women with carcinoma : potential biomarkers of susceptibility to
cancer. Carcinogenesis. 2003; 24:697–702. [PubMed : 12727798]
4. Cavalieri EL, Stack DE, Devanesan PD, et al. Molecular origin of cancer: catechol estrogen-3, 4-quinones as endogenous tumor initiators. Proc. Natl. Acad. Sci. USA. 1997; 94:10937–10942.
[PubMed : 9380738]
5. Li K-M, Todorovic R, Devanesan P, et al. Metabolism and DNA binding studies of 4-hydroxyestradiol and estradiol-3, 4-quinone in vitro and in female ACI rat mammary gland in vivo.
Carcinogenesis. 2004; 25:289–297. [PubMed : 14578156]
6. Zahid M, Kohli E, Saeed M, Rogan E, Cavalieri E. The greater reactivity of estradiol-3, 4-quinone versus estradiol-2, 3-quinone with DNA in the formation of depurinating DNA adducts:
implications for tumor-initiating activity. Chem. Res. Toxicol. 2006; 19:164–172. [PubMed : 16411670]
7. Gaikwad NW, Yang L, Muti P, et al. The molecular etiology of breast cancer: evidence from biomarkers of risk. Int. J. Cancer. 2008; 122:1949–1957. [PubMed : 18098283]
8. Yang L, Gaikwad N, Meza J, et al. Novel biomarkers for risk of prostate cancer: results from a case–control study. Prostate. 2009; 69:41–48. [PubMed : 18816637]
9. Chakravarti D, Mailander P, Li K-M, et al. Evidence that a burst of DNA depurination in SENCAR mouse skin induces error-prone repair and forms mutations in the H-ras gene. Oncogene. 2001;
20:7945–7953. [PubMed : 11753677]
10. Mailander PC, Meza JL, Higginbotham S, Chakravarti D. Induction of A.T to G.C mutations by erroneous repair of depurinated DNA following estrogen treatment of the mammary gland of ACI
rats. J. Steroid Biochem. Mol. Biol. 2006; 101:204–215. [PubMed : 16982187]
11. Zhao Z, Kosinska W, Khmelnitsky M, et al. Mutagenic activity of 4-hydroxyestradiol, but not 2-hydroxyestradiol, in BB rat2 embryonic cells, and the mutational spectrum of 4-hydroxyestradiol.
Chem. Res. Toxicol. 2006; 19:475–479. [PubMed : 16544955]
12. Cavalieri E, Chakravarti D, Guttenplan J, et al. Catechol estrogen quinones as initiators of breast and other human cancers : implications for biomarkers of susceptibility and cancer prevention.
BBA Rev. Cancer. 2006; 1766:63–78.
13. Fernandez SV, Russo IH, Russo J. Estradiol and its metabolites 4-hydroxyestradiol and 2-hydroxyestradiol induce mutations in human breast epithelial cells. Int. J. Cancer. 2006;
118:1862–1868. [PubMed : 16287077]
14. Russo J, Fernandez SV, Russo PA, et al. 17-Beta-estradiol induces transformation and tumorigenesis in human breast epithelial cells. FASEB J. 2006; 20:1622–1634. [PubMed :
16873885]
15. Venugopal D, Zahid M, Mailander PC, et al. Reduction of estrogen-induced transformation of mouse mammary epithelial cells by N-acetylcysteine. J. Steroid Biochem. Mol. Biol. 2008;
109:22–30. [PubMed : 18226522]
16. Lu F, Zahid M, Wang C, Saeed M, Cavalieri EL, Rogan EG. Resveratrol prevents estrogen–DNA adduct formation and neoplastic transformation in MCF-10F cells. Cancer Prev. Res. 2008; 1:135–
145.
17. Liehr JG, Fang WF, Sirbasku DA, Ari-Ulubelen A. Carcinogenicity of catecholestrogens in Syrian hamsters. J. Steroid Biochem. 1986; 24:353–356. [PubMed : 3009986]
18. Li JJ, Li SA. Estrogen carcinogenesis in Syrian hamster tissue: role of metabolism. Fed. Proc. 1987; 46:1858–1863. [PubMed : 3030825]
19. Newbold RR, Liehr JG. Induction of uterine adenocarcinoma in CD-1 mice by catechol estrogens. Cancer Res. 2000; 60:235–237. [PubMed : 10667565]
20. Yue W, Santen RJ, Wang JP, et al. Genotoxic metabolites of estradiol in breast : potential mechanism of estradiol induced carcinogenesis. J. Steroid Biochem. Mol. Biol. 2003; 86:477–486.
[PubMed : 14623547]
21. Cavalieri EL, Rogan EG. Depurinating estrogen–DNA adducts in the etiology and prevention of breast and other human cancers. Future Oncol. 2010; 6:75–91. [PubMed : 20021210]
22. Gaikwad NW, Yang L, Pruthi S, et al. Urine biomarkers of risk in the molecular etiology of breast cancer. Breast Cancer : Basic Clin. Res. 2009; 3:1–8.
23. Lu F, Zahid M, Saeed M, Cavalieri EL, Rogan EG. Estrogen metabolism and formation of estrogen–DNA adducts in estradiol-treated MCF-10F cells: the effects of 2, 3, 7, 8-
tetrachlorodibenzo-p-dioxin induction and catechol-O-methyltransferase inhibition. J. Steroid Biochem. Mol. Biol. 2007; 105:150–158. [PubMed : 17582757]
24. Zahid M, Saeed M, Lu F, Gaikwad N, Cavalieri EL, Rogan EG. Inhibition of catechol-O-methyltransferase increases estrogen–DNA adduct formation. Free Radic. Biol. Med. 2007;
43:1534–1540. [PubMed : 17964424]
25. Gaikwad NW, Rogan EG, Cavalieri EL. Evidence from ESI-MS for NQO1-catalyzed reduction of estrogen ortho-quinones. Free Radic. Biol. Med. 2007; 43:1289–1298. [PubMed : 17893042]
26. Montano MM, Chaplin LJ, Deng H, et al. Protective roles of quinone reductase and tamoxifen against estrogen-induced mammary tumorigenesis. Oncogene. 2007; 26:3587–3590. [PubMed :
17160017]
27. Gaikwad NW, Yang L, Rogan EG, Cavalieri EL. Evidence for NQO2-mediated reduction of the carcinogenic estrogen ortho-quinones. Free Radic. Biol. Med. 2009; 46:253–262. [PubMed :
18996184]
28. Zahid M, Gaikwad N, Cavalieri EL, Rogan EG. Inhibition of depurinating estrogen–DNA adduct formation by natural compounds. Chem. Res. Toxicol. 2007; 20:1947–1953. [PubMed : 18039013]
29. Bonanomi L, Gazzaniga A. Toxicological, pharmacokinetic and metabolic studies on acetylcysteine. Eur. J. Respir. Dis. Suppl. 1980; 111:45–51. [PubMed : 6938410]
30. Townsend DM, Tew KD, Tapiero H. The importance of glutathione in human diseases. Biomed. Pharmacother. 2003; 57:145–155. [PubMed : 12818476]
31. Webb WR. New mucolytic agents for sputum liquefaction. Postgrad. Med. 1964; 36:449–453. [PubMed : 14212497]
32. Flanagan RJ. The role of acetylcysteine in clinical toxicology. Med. Toxicol. 1987; 2:93–104. [PubMed : 3574040]
33. Doelman CJ, Bast A. Oxygen radicals in lung pathology. Free Radic. Biol. Med. 1990; 9:381–400. [PubMed : 1705530]
34. De Flora S, Cesarone CF, Balansky RM, et al. Chemopreventive properties and mechanisms of N-acetylcysteine: the experimental background. J. Cell. Biochem. Suppl. 1995; 22:33–41. [PubMed :
8538208]
35. Grandjean EM, Berthet P, Ruffmann R, Leuenberger P. Efficacy of oral long-term N-acetylcysteine in chronic bronchopulmonary disease : a meta-analysis of published double-blind,
placebo-controlled clinical trials. Clin. Ther. 2000; 22:209–221. [PubMed : 10743980]
36. De Flora S, Izzotti A, D’Agostini F, Cesarone CF. Antioxidant activity and other mechanisms of thiols involved in chemoprevention of mutation and cancer. Am. J. Med. 1991; 91:122S–130S.
[PubMed : 1928203]
37. Jang M, Cai L, Udeani GO. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes. Science. 1997; 275:218–220. [PubMed : 8985016]
38. Surh YJ. Cancer chemoprevention with dietary phytochemicals. Nat. Rev. Cancer. 2003; 3:768–780. [PubMed : 14570043]
39. Aziz MH, Kumar R, Ahmad N. Cancer chemoprevention by resveratrol: in vitro and in vivo studies and the underlying mechanisms. Int. J. Oncol. 2003; 23:17–28. [PubMed : 12792772]
40. Zahid M, Gaikwad N, Ali MF, et al. Prevention of estrogen–DNA adducts in MCF-10F cells by resveratrol. Free Radic. Biol. Med. 2008; 45:136–145. [PubMed : 18423413]
41. Zahid M, Saeed M, Ali MF, Rogan EG, Cavalieri EL. N-acetylcysteine blocks formation of cancer-initiating estrogen–DNA adducts in cells. Free Radic. Biol. Med. 2010; 49:392–400. [PubMed :
20472053]
42. Saeed M, Zahid M, Rogan EG, Cavalieri EL. Synthesis of the catechols of natural and synthetic estrogens by using 2-iodoxybenzoic acid (IBX) as the oxidizing agent. Steroids. 2005; 70:173–
178. [PubMed : 15763595]
43. Cao K, Stack DE, Ramanathan R, Gross ML, Rogan EG, Cavalieri EL. Synthesis and structure elucidation of estrogen quinones conjugated with cysteine N-acetylcysteine and glutathione.
Chem. Res. Toxicol. 1998; 11:909–916. [PubMed : 9705753]
44. Denizot F, Lang R. Rapid colorimetric assay for cell growth and survival : modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J. Immunol. Meth. 1986;
89:271–277.
45. Huynh H, Feldt LS. Estimation of the box correction for degrees of freedom from sample data in the randomized block and split-plot designs. J. Educ. Behav. Stats. 1976; 1:69–82.
46. Bliss CI. The toxicity of poisons applied jointly. Ann. Appl. Biol. 1939; 26:585–615.
47. Samuni AM, Chuang EY, Krishna MC, et al. Semiquinone radical intermediate in catecholic estrogen-mediated cytotoxicity and mutagenesis: chemoprevention strategies with antioxidants.
Proc. Natl. Acad. Sci. USA. 2003; 100:5390–5395. [PubMed : 12702779]







![Super Armi energetiche. Il ruolo di HAARP Screenshot 2021-10-22 at 13-00-51 Microsoft Word – Ppr2018 0053ma-Shesspari docx – Sheshpari-Paper-Direct-Energy-Weapons-In[…]](https://it.nuda-verita.com/wp-content/uploads/2021/10/Screenshot-2021-10-22-at-13-00-51-Microsoft-Word-Ppr2018-0053ma-Shesspari-docx-Sheshpari-Paper-Direct-Energy-Weapons-In.-e1634921563638-150x150.png)